Vlad Krasen
0
2321
33
Na konci 19. století zveřejnil ruský chemik Dmitri Mendeleev svůj první pokus o seskupení chemických prvků podle atomových hmotností. V té době bylo známo pouze asi 60 prvků, ale Mendeleev si uvědomil, že když byly prvky uspořádány podle váhy, vyskytly se určité typy prvků v pravidelných intervalech nebo obdobích.
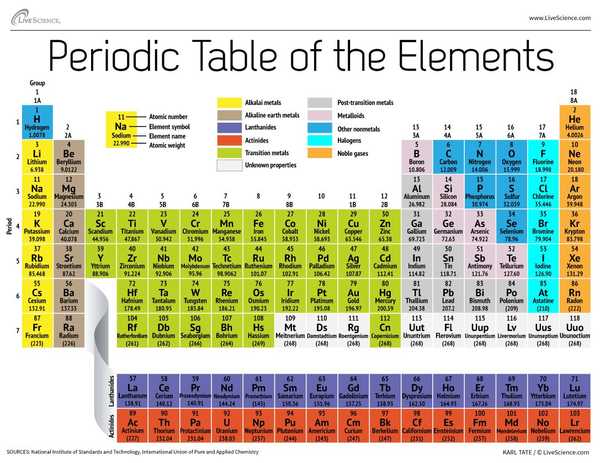
Dnes, o 150 let později, chemici oficiálně rozpoznají 118 prvků (po přidání čtyř nově příchozích v roce 2016) a stále je používají Mendělejevovy periodické tabulky prvků k jejich organizaci. Tabulka začíná nejjednodušším atomem, vodíkem a potom organizuje zbytek prvků podle atomového čísla, což je počet protonů, které každý obsahuje. Až na několik výjimek odpovídá pořadí prvků rostoucí hmotnosti každého atomu.
Tabulka má sedm řádků a 18 sloupců. Každý řádek představuje jednu periodu; číslo periody prvku udává, kolik z jeho energetických úrovní obsahuje elektrony. Například sodík sedí ve třetím období, což znamená, že atom sodíku má obvykle elektrony v prvních třech energetických úrovních. Po posunutí stolu jsou periody delší, protože zaplnění větší a složitější vnější úrovně vyžaduje více elektronů.
Sloupce tabulky představují skupiny nebo rodiny prvků. Prvky ve skupině často vypadají a chovají se podobně, protože ve svém nejvzdálenějším obalu mají stejný počet elektronů - tvář, kterou ukazují světu. Například prvky skupiny 18, na zcela pravé straně stolu, mají zcela plné vnější skořápky a zřídka se účastní chemických reakcí.
Prvky jsou obvykle klasifikovány jako kovové nebo nekovové, ale dělicí čára mezi nimi je nejasná. Kovové prvky jsou obvykle dobrými vodiči elektřiny a tepla. Podskupiny v rámci kovů jsou založeny na podobných vlastnostech a chemických vlastnostech těchto sbírek. Náš popis periodické tabulky používá běžně přijímaná seskupení prvků podle Národní laboratoře Los Alamos.
Alkalické kovy: Alkalické kovy tvoří většinu ze skupiny 1, první sloupec tabulky. Tyto kovy jsou dostatečně lesklé a měkké na to, aby se mohly řezat nožem, začínají lithiem (Li) a končící francií (Fr). Jsou také extrémně reaktivní a při kontaktu s vodou propuknou v plamen nebo dokonce explodují, takže je chemici ukládají v olejích nebo inertních plynech. Vodík se svým jediným elektronem žije také ve skupině 1, ale plyn je považován za nekovový.
Kovy alkalických zemin: Kovy alkalických zemin tvoří skupinu 2 periodické tabulky, od berylia (Be) po radium (Ra). Každý z těchto prvků má ve své nejvzdálenější energetické úrovni dva elektrony, díky čemuž jsou alkalické zeminy dostatečně reaktivní, takže se v přírodě jen zřídka nacházejí. Ale nejsou tak reaktivní jako alkalické kovy. Jejich chemické reakce se obvykle vyskytují pomaleji a ve srovnání s alkalickými kovy produkují méně tepla.
Lanthanides: Třetí skupina je příliš dlouhá na to, aby se vešla do třetího sloupce, takže je vylomena a převrácena do stran, aby se stala horní řadou ostrova, který se vznáší ve spodní části stolu. Toto jsou lantanidy, prvky 57 až 71 - lantan (La) až lutetium (Lu). Prvky v této skupině mají stříbrnou bílou barvu a po kontaktu se vzduchem poskvrňují.
Actinides: Aktinidy lemují spodní řadu ostrova a obsahují prvky 89, aktinium (Ac), až 103, lawrencium (Lr). Z těchto prvků se na Zemi vyskytuje přirozeně pouze thium (Th) a uran (U) ve značném množství. Všechny jsou radioaktivní. Actinidy a lanthanidy společně tvoří skupinu zvanou vnitřní přechodné kovy.
Přechodové kovy: Po návratu do hlavního těla tabulky představují zbytek skupin 3 až 12 zbytek přechodných kovů. Tyto prvky jsou tvrdé, ale poddajné, lesklé a mají dobrou vodivost, a ty obvykle myslíš, když uslyšíš slovo kov. Žije zde mnoho z největších hitů metalového světa - včetně zlata, stříbra, železa a platiny.
Kovy po přechodu: Před skokem do nekovového světa nejsou sdílené charakteristiky úhledně rozděleny podél svislých skupinových čar. Kovy po přechodu jsou hliník (Al), gallium (Ga), indium (In), thallium (Tl), cín (Sn), olovo (Pb) a bizmut (Bi) a zahrnují skupinu 13 až 17. Tyto prvky mají některé z klasických vlastností přechodných kovů, ale mají tendenci být měkčí a chovat se špatněji než jiné přechodné kovy. Mnoho periodických tabulek bude mít pod tučnou linkou „schodiště“ pod diagonálním spojovacím bórem s astatinem. Kovy po přechodu se shlukují vlevo dole od této čáry.
Metaloidy: Metaloidy jsou bor (B), křemík (Si), germanium (Ge), arsen (As), antimon (Sb), telur (Te) a polonium (Po). Tvoří schodiště, které představuje postupný přechod od kovů k nekovům. Tyto prvky se někdy chovají spíše jako polovodiče (B, Si, Ge) než jako vodiče. Metaloidy se také nazývají „semimetaly“ nebo „chudé kovy“.
Nonmetals: Všechno ostatní vpravo nahoře na schodišti - plus vodík (H), uvíznutá cesta zpět ve skupině 1 - je nekovová. Patří sem uhlík (C), dusík (N), fosfor (P), kyslík (O), síra (S) a selen (Se).
Halogeny: Čtyři hlavní prvky skupiny 17, od fluoru (F) po astatin (At), představují jednu ze dvou podmnožin nekovů. Tyto halogeny jsou celkem chemicky reaktivní a mají tendenci se párovat s alkalickými kovy za vzniku různých typů solí. Například stolní sůl ve vaší kuchyni je manželstvím mezi sodíkem alkalického kovu a halogenem chloru.
Vzácné plyny: Inertní nebo ušlechtilé plyny, které jsou bezbarvé, bez zápachu a téměř úplně nereaktivní, zaokrouhlují stůl ve skupině 18. Mnoho chemiků očekává, že oganesson, jeden ze čtyř nově jmenovaných prvků, bude sdílet tyto vlastnosti; nicméně, protože tento prvek má poločas rozpadu v milisekundách, nikdo jej nebyl schopen přímo vyzkoušet. Oganesson dokončí sedmou periodu periodické tabulky, takže pokud se někomu podaří syntetizovat prvek 119 (a závod, který tak učiní, již probíhá), bude kolem dokola začínat osmičku ve sloupci alkalického kovu.
Kvůli cyklické povaze vytvořené periodicitou, která dává tabulce její jméno, někteří chemici dávají přednost vizualizaci Mendeleevovy tabulky jako kruhu.
Další zdroje:
- Podívejte se na toto krátké video o periodické tabulce a skupinách prvků z kurzu Crash.
- Listujte touto interaktivní periodickou tabulkou prvků.
- Podívejte se na tento bezplatný online vzdělávací zdroj pro pochopení elementárních skupin z CK-12.















